La química puede llegar a ser especialmente complicada, con lo cual toda herramienta que permita facilitar su aprendizaje a los que se introducen en ella es bienvenida.
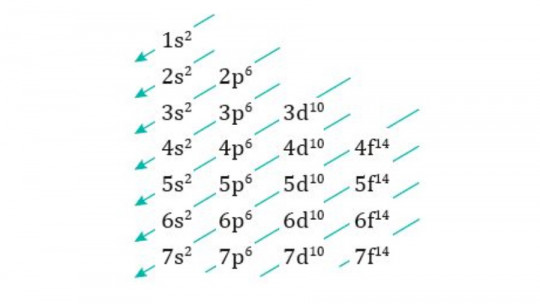
Uno de los métodos más populares para familiarizarse con la regla de Madelung y la configuración electrónica de los átomos es el diagrama de Moeller, una regla mnemotécnica de tipo gráfico que facilita mucho ver en qué orbitales se ubican los electrones.
A continuación vamos a descubrir en qué consiste el diagrama de Moeller, cómo se relaciona con la regla de Madelung, cómo se aplica mediante unos cuantos ejemplos solucionados y qué elementos químicos no obedecen a esta estrategia.
- Artículo relacionado: "Los 5 tipos de enlaces químicos: así se compone la materia"
¿Qué es el diagrama de Moeller?
El diagrama de Moeller, también conocido como método de la lluvia o regla de las diagonales, es un método gráfico y mnemotécnico para aprender la regla de Madelung, una técnica para conocer y escribir la configuración electrónica de los elementos químicos.
Este diagrama se caracteriza por trazar unas diagonales por las columnas de los orbitales, en sentido de arriba hacia abajo de derecha a izquierda. A través del diagrama de Moeller se define un orden en el llenado de los orbitales, los cuales estarán definidos por tres números cuánticos: n, l y ml.
El diagrama de Moeller funciona atendiendo a lo siguiente:

Cada columna se corresponde a un orbital diferente por los que circulan los electrones de un átomo, partículas subatómicas que tienen carga negativa. Los orbitales en cuestión son: s, p, d y f, cada uno con un espacio concreto para albergar electrones y, por lo tanto, diferentes niveles de energía.
Si trazamos las diagonales o flechas en el sentido anteriormente mencionado, tenemos que el primer orbital es 1s. La segunda flecha empieza por el orbital 2s. La tercera flecha cruza 2p y 3s. La cuarta diagonal es 3p y 4s. La quinta diagonal es 3d, 4p y 5s y, así, sucesivamente. El diagrama de Moeller es una técnica introductoria para quienes empiezan a estudiar en química las configuraciones electrónicas de los elementos de la tabla periódica.
- Quizás te interese: "Las 6 principales ramas de las ciencias naturales"
La regla de Madelung
Dado que el diagrama de Moeller es la representación gráfica de la regla de Madelung (conocida también como regla de Klechkovsky en algunos países) primero debemos conocer de qué se trata. De acuerdo con esta regla, el llenado de los orbitales de un átomo debe obedecer las siguientes dos reglas:
Primera regla de Madelung
Los orbitales con los menores valores de n+l se llenan primero, siendo n el número cuántico principal, y l el momento angular orbital.
Por ejemplo, el orbital 3d corresponde a n=3 y l=2. Por lo tanto, n+l=3+2=5. En cambio, el orbital 4s corresponde a n=4 y l=0, siendo por lo tanto n+l=4+0=4. De esto se establece que los electrones llenan primero el orbital 4s antes que el 3d, porque 4s=4 mientras que 3d=5.
- Artículo relacionado: "Los 11 tipos de reacciones químicas"
Segunda regla de Madelung
Si dos orbitales tienen el mismo valor de n+l, los electrones ocuparán primero aquel con menor valor de n.
Por ejemplo, el orbital 3d tiene un valor de n+l=5, idéntico al del orbital 4p (4+1=5) pero, como el orbital 3d tiene el menor valor para n éste se llenara primero que el orbital 4p.
De todas estas observaciones y reglas, se puede llegar al siguiente orden en el llenado de los orbitales atómicos: 1s 2s 2p 3s 3p 4s 3d 4p. Pese a que este orden es fijo, recordarlo de memoria es complicado, motivo por el cual existe el diagrama de Moeller que viene a representar gráficamente su orden.
- Quizás te interese: "Los 9 postulados de la teoría atómica de Dalton"
Pasos a seguir al usar el diagrama de Moeller
Como hemos comentado en el apartado anterior, la regla de Madelung usa la fórmula n+l para establecer qué orbitales se llenan antes y a partir de ese determinar cuál es la configuración electrónica de un elemento determinado. Sin embargo, el diagrama de Moeller ya representa de forma gráfica y sencilla esto, de modo que basta con seguir las columnas del mismo diagrama y dibujar diagonales para descubrir en qué orden se llenan los orbitales de cada elemento.
Para descubrir la configuración electrónica de un átomo y en qué orbitales se ubican sus electrones primero debemos conocer su número atómico Z. El número Z se corresponde con el número de electrones de un átomo, siempre y cuando este átomo sea neutro, o lo que es lo mismo, que no sea un ión, ni positivo (catión) ni negativo (anión).
Así pues, conociendo Z para un átomo neutro ya conocemos cuántos electrones suele tener un átomo neutro de ese elemento. Teniendo esto en mente, comenzaremos a trazar las diagonales en el diagrama de Moeller. Debemos tener en cuenta que cada tipo de orbital tiene una capacidad diferente para albergar electrones, los cuales son:
- s = 2 electrones
- p = 6 electrones
- d = 10 electrones
- f = 14 electrones
Se detiene en el orbital donde se haya ocupado el último electrón dado por Z.
Ejemplos del diagrama de Moeller
Para entender mejor cómo funciona el diagrama de Moeller, a continuación vamos a ver unos cuantos ejemplos prácticos de establecimiento de la configuración electrónica de diferentes elementos.
Berilio
Para establecer la configuración electrónica de un átomo neutro de berilio (Be) lo que primero debemos hacer es buscarlo en la tabla periódica, un alcalinotérreo que se ubica en la segunda columna y segunda fila de la tabla. Su número atómico es 4, por lo tanto Z=4 y tiene, también, 4 electrones.
Teniendo en cuenta todo esto, vamos a usar el diagrama de Moeller para ver de qué forma se ubican los 4 electrones de este elemento. Empezamos haciendo diagonales en el sentido anteriormente mencionado, de arriba a abajo y de derecha a izquierda.
Cuando vamos llenando orbitales, se recomienda poner la cantidad de electrones que se encuentran en cada uno de ellos a modo de superíndice. Como 1s es el primer orbital y este ocupa dos electrones, lo escribiremos:
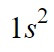
Como todavía nos quedan electrones libres, continuamos rellenando orbitales. El siguiente es el orbital 2s y, al igual que con 1s, ocupa 2 electrones, por lo tanto 2s2. Como ya tenemos todos los electrones bien ubicados en los orbitales del átomo neutro de Be podemos decir que la configuración electrónica de este elemento es:
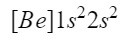
Nos aseguramos que lo hemos hecho bien sumando los superíndices: 2+2=4
- Quizás te interese: "Teoría cinético molecular: los 3 estados de la materia"
Fósforo
El elemento fósforo (P) es un no metal que se encuentra en la tercera fila y la columna 16 de la tabla periódica, con Z=15, por lo tanto tiene 15 electrones en total que deben ocupar los orbitales.
Habiendo visto el ejemplo anterior, podemos adelantar un poco el camino y ubicar 4 de sus electrones en los mismos orbitales que tiene el berilio para sus 4 electrones, faltándonos ubicar 9 electrones más.
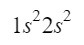
Después del orbital 2s, la siguiente diagonal entra por el orbital 2p y termina en el orbital 3s. El orbital 2p puede ocupar 6 electrones, y en el caso de 3s solo 2. Así pues, tendríamos:
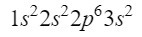
De momento tenemos bien ubicados 12 electrones, pero todavía nos faltan 3 más. Hacemos otra diagonal y esta vez entramos por el orbital 3p según el diagrama de Moeller, un orbital que tiene espacio para 6 electrones, pero como solo nos quedan 3 electrones este orbital no va a estar completamente ocupado, poniendo como superíndice un 3. Así pues, para acabar con el fósforo, su configuración electrónica es la siguiente:
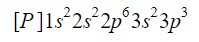
Nos aseguramos que lo hemos hecho bien sumando los superíndices: 2+2+6+2+3=15
Zirconio
El elemento zirconio (Zr) es un metal de transición se encuentra en la columna 4 y la fila 5 y tiene un Z=40. Acortando camino aprovechando el ejemplo anterior, podemos ubicar los primeros 18 electrones.
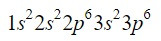
Después del orbital 3p, los siguientes en llenarse guiándonos con el diagrama de Moeller son los orbitales 4s, 3d, 4p y 5s, con capacidad para 2, 10, 6 y 2 electrones respectivamente.
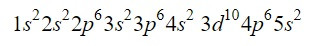
Al completar los primeros nueve orbitales del diagrama se suma un total de 20 electrones, quedando los 2 electrones restantes que se alojan en el siguiente orbital, el 4d. Así pues, la configuración electrónica del elemento zirconio neutro es:
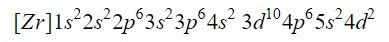
Nos aseguramos que lo hemos hecho bien sumando los superíndices: 2+2+6+2+6+2+10+6+2+2=40
Oxígeno
Aquí vemos un ejemplo un poco más complicado que es el del oxígeno (O). Este gas se encuentra en la columna 16 y la fila 2 de la tabla periódica, es un no metal y tiene como número atómico 8.
Hasta aquí, viendo los demás ejemplos, pensaríamos que su Z=8, sin embargo no es tan sencillo pues este gas es de naturaleza especial, encontrándose casi siempre en forma de ión con carga de -2.
Esto quiere decir que, si bien un átomo neutro de oxígeno sí tiene 8 electrones tal y cómo indica su número atómico, lo cierto es que en la naturaleza presenta más, en su caso 10 (8 electrones + 2 electrones o, si se prefiere, -8 de carga eléctrica -2).
Así pues, en este caso, la cantidad de electrones que tenemos que ubicar en los orbitales no es 8 sino 10 electrones, como si estuviéramos ubicando los electrones del elemento químico neón que sí tiene Z=10.
Entendido esto, solo tenemos que hacer lo mismo que hemos ido haciendo en los casos anteriores solo teniendo en cuenta que estamos trabajando con un ión (anión):
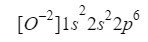
Nos aseguramos que lo hemos hecho bien sumando los superíndices: 2+2+6=10
Calcio
Al calcio (Ca) le sucede algo parecido al oxígeno, solo que en este caso hablamos de un catión, esto es, un ión de carga positiva.
Este elemento se encuentra en la columna 2 fila 4 de la tabla periódica con número atómico de 20, sin embargo, en la naturaleza se suele presentar en forma de ión con carga positiva +2, lo que quiere decir que su carga electrónica es de 18 (- 20 + 2 = 18; 20 electrones - 2 electrones = 18 electrones).
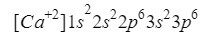
Nos aseguramos que lo hemos hecho bien sumando los superíndices: 2+2+6+2+6=18
Excepciones al diagrama de Moeller y la regla de Madelung
A pesar de que el diagrama de Moeller es muy útil para entender la regla de Madelung y saber cómo se ubican los electrones de los diferentes elementos químicos, lo cierto es que no es infalible. Hay ciertas sustancias cuya composición no obedece lo que hemos explicado.
Sus configuraciones electrónicas difieren experimentalmente de las que la regla de Madelung predice por razones cuánticas. Entre estos elementos que no siguen las normas tenemos: cromo (Cr, Z=24), cobre (Cu, Z=29), plata (Ag, Z=47), rodio (Rh, Z=45), cerio (Ce, Z=58), niobio (Nb; Z=41), entre otros.
Las excepciones son muy frecuentes a la hora de llenar los orbitales d y f. Por ejemplo, en el caso del cromo, que debería tener una configuración de valencia acabada en 4s^2 3d^4 según el diagrama de Moeller y la regla de Madelung, en realidad la tiene de 4s^1 3d^5. Otro ejemplo extraño es el de la plata, que en vez de tener como última 5s^2 4d^9 tiene 5s^1 4d^10.


Newsletter PyM
La pasión por la psicología también en tu email
Únete y recibe artículos y contenidos exclusivos
Suscribiéndote aceptas la política de privacidad