¿Cuántos elementos químicos deben existir en el universo? A esta pregunta todavía le queda mucho para ser respondida, puesto que los científicos van creando sus propios elementos químicos artificiales cada cierto tiempo.
Sin embargo, a lo que sí podemos responder es a cuántos tipos de elementos químicos deben existir, algo que vamos a averiguar a continuación.
- Artículo relacionado: "Los 11 tipos de reacciones químicas"
Los tipos de elementos químicos
En la naturaleza podemos encontrar todo tipo de sustancias. Estas sustancias no suelen encontrarse en estado puro, sino que son el resultado de la combinación de diferentes elementos o materiales que mediante diferentes reacciones, procesos y períodos de tiempo han dado lugar a toda clase de materia. No hay nada en el universo que no sea el resultado de la combinación de átomos pertenecientes a diferentes tipos de elementos químicos, los cuales vamos a ver en profundidad.
Sin embargo, antes de ver los tipos de elementos químicos hagamos un poco de repaso de ciencias naturales de secundaria y recordemos qué son los elementos químicos.
Llamamos “elemento químico” a la materia que está compuesta de un mismo tipo de átomo, es decir, una sustancia que es atómicamente pura. Los elementos químicos no pueden ser descompuestos en otros más simples y se encuentran clasificados en la tabla periódica de los elementos como materiales puros del universo.
Pero, ¡ojo! no debemos confundir a los elementos con las sustancias simples, puesto que en ciertos casos dos o más átomos de un mismo elemento pueden componer moléculas agrupadas de maneras distintas que hacen que varíen algunas de las propiedades físicas del elemento en cuestión, siendo estos casos los isótopos. Por ejemplo, el diamante y el carbón son sustancias hechas a partir del elemento químico carbono (C) pero que se organiza de formas distintas y da como resultado dos materiales completamente diferentes.
Carl Sagan decía que somos polvo de estrellas reflexionando sobre estrellas. Esta tan bella frase no es una mera metáfora, sino un hecho científico. Los elementos químicos se forman, hasta donde sabemos, en el interior de las estrellas siendo el resultado de complejos procesos de fusión y fisión atómica que generan cada vez elementos más pesados, resultado de un proceso llamado nucleosíntesis.
La mayoría de los elementos conocidos se pueden obtener de la naturaleza, encontrándose de manera espontánea o formando compuestos con otros elementos como el uranio (U), el carbono (C), el silicio (Si), la plata (Ag) o el oro (Au). Otros, en cambio, han sido fabricados en laboratorios como por ejemplo el americio (Am), el berkelio (Bk) o el curio (Cm). Sea cuál sea su método de obtención o si se encuentra presente en la naturaleza, en función de sus propiedades el elemento químico en cuestión tendrá unos usos u otros.
En la actualidad se conocen unos 118 elementos químicos aunque teniendo en cuenta que el ser humano ha sido capaz de fabricar nuevos elementos es cuestión de tiempo que la tabla periódica se expanda.
- Quizás te interese: "Los 2 tipos de electricidad (explicados)"
Los principales tipos de elementos químicos
Los principales tipos de elementos químicos son representados en la tabla periódica, un sistema de clasificación creado por el químico ruso Dmitri Mendeléyev (1834-1907) que sentó sus cimientos en 1869. Los elementos químicos son ordenados visualmente a partir de sus propiedades y características.
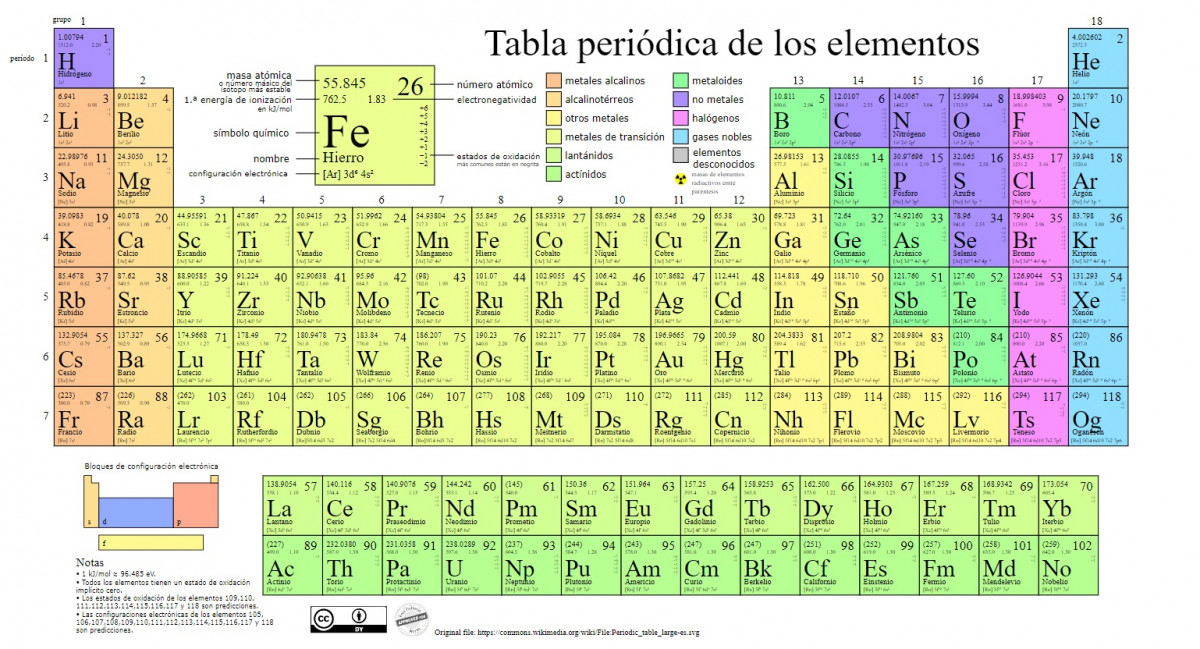
Con el paso del tiempo y a medida que la química iba haciendo importantes hallazgos científicos, esta tabla sería expandida consecutivamente, alcanzando la forma que tiene hoy en día con los 118 elementos conocidos hasta el momento.
En la actualidad, en esta tabla podemos encontrar los siguientes tipos de elementos químicos:
1. Metales
Los metales son elementos químicos que, generalmente, contienen entre uno y tres electrones en la última órbita de su átomo, electrones los cuales los pueden ceder con facilidad convirtiéndolos en conductores de calor y electricidad.
Los metales suelen ser maleables y dúctiles, con un brillo característico cuya intensidad depende del movimiento de los electrones que componen sus átomos. En la mayoría de las ocasiones, los metales son sólidos a temperatura ambiente, a excepción del mercurio.
Entre los metales encontramos el oro (Au), la plata (Ag), el cobre (Cu) y el aluminio (Al) cuyas características físicas los hace unos magníficos conductores de la electricidad, aunque su presencia en la naturaleza sea muy variada, reflejándose en la diferencia entre sus pesos.
Se cree que el 75% de los elementos químicos existentes en la naturaleza son metales, mientras que el 25% restante estaría constituido por gases nobles, metaloides y demás tipologías.
Existen clasificaciones dentro de esta categoría, encontrando los actínidos, lantánidos, metales de transición, metales alcalinos, alcalinotérreos y otros metales.
- Artículo relacionado: "10 alimentos con alto contenido en Zinc"
1.1. Lantánidos
Los elementos lantánidos se encuentran en depósitos formados por muchos minerales. Son metales de color blanco que se oxidan con facilidad al entrar en contacto con el aire. Entre ellos encontramos lantano (La), prometio (Pm), europio (Eu) e iterbio (Yb).

- Quizás te interese: "Los 5 tipos de enlaces químicos: así se compone la materia"
1.2. Actínidos
Todos los isótopos de los actínidos son radiactivos. Entre ellos encontramos actinio (Ac), uranio (U), plutonio (Pu) y einstenio (Es).
1.3. Metales de transición
Los metales de transición están situados en la parte central del sistema periódico. Su principal característica es que tienen configuración electrónica del orbital “d” parcialmente lleno de electrones.
En este grupo hay sustancias de todo tipo y, según su clasificación más amplia, se correspondería con los elementos químicos del 21 al 30, del 39 al 48, del 71 al 80 y del 103 al 112, siendo un total de cuarenta y entre ellos encontraríamos vanadio (V), rutenio (Ru), plata (Ag), tantalio (Ta) y lawrencio (Lr).

1.4. Metales alcalinos
Los metales alcalinos es un grupo de seis elementos compuesto por litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr). Son metales brillantes, blandos, altamente reactivos a temperatura y presión normal y pierden fácilmente su electrón externo, situado en su orbital “s”.
1.5. Alcalinotérreos
Los metales alcalinotérreos son un grupo de elementos en el que encontramos berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba) y radio (Ra). Su nombre proviene del nombre que recibían sus óxidos, “tierras”, que tienen propiedades básicas o alcalinas.
Los alcalinotérreos son más duros que los alcalinos, brillan y son buenos conductores eléctricos. Son menos reactivos que los alcalinos y actúan como buenos agentes reductores. Tienen la capacidad de formar compuestos iónicos y todos ellos tienen dos electrones en su capa más exterior.

1.6. Otros metales
La categoría “otros metales” es un tipo de sustancias que se encuentran aquí porque no se sabe muy bien donde ponerlas.
Son elementos metálicos situados en la tabla periódica junto con los metaloides, dentro del bloque p. Tienden a ser blandos con puntos de fusión bajos. Dentro de ellos se encuentran el aluminio (Al), el indio (In), el estaño (Sn) y el bismuto (Bi) entre otros.

2. No metales
Los no metales poseen generalmente entre cinco y siete electrones en su última órbita, propiedad la cual hace que ganen electrones en vez de cederlos y, así, consiguen tener ocho electrones que así los estabiliza como átomos.
Estos elementos son muy malos conductores del calor y la electricidad. Añadido a esto, no poseen un brillo característico, son poco maleables, poco dúctiles y son muy frágiles en estado sólido. No se pueden laminar ni estirar, a diferencia de los metales.
En su mayoría son esenciales para los sistemas biológicos, puesto que están presentes en los compuestos orgánicos, como lo son el azufre (S), el carbono (C), el oxígeno (O), el hidrógeno (H) y el yodo (I).

- Artículo relacionado: "Los 20 tipos de piedras preciosas (descritas y con imágenes)"
3. Metaloides
Como su nombre viene a sugerir, los metaloides son una clasificación intermedia entre los metales y no metales que poseen propiedades de ambos grupos. Esto es debido a que poseen cuatro átomos en su última órbita, cantidad intermedia a la que poseen los metales y los no metales.
Estos elementos químicos conducen la electricidad solamente en un sentido, no permitiendo que se haga en sentido contrario como sí ocurre en los metales. Un ejemplo de ello lo tenemos en el silicio (Si), un metaloide usado en la fabricación de elementos semiconductores para la industria electrónica gracias a esta propiedad.
Otros metaloides son: boro (B), arsénico (As), antimonio (Sb) y polonio (Po).

4. Halógenos
Los halógenos son un grupo de seis elementos que tienden a formar moléculas compuestas por dos átomos (diatómicas) muy activas químicamente debido a su electronegatividad.
Estas sustancias suelen presentarse en forma de iones, esto es, moléculas cargadas eléctricamente, que en este caso son mononegativos, altamente oxidantes. Esto se traduce en que los halógenos son sustancias cáusticas y corrosivas.
Los halógenos son: flúor (F), cloro (Cl), bromo (Br), yodo (I), astato (At) y teneso (Ts).

5. Gases nobles
Los gases nobles son un grupo de siete cuyo estado natural es el gaseoso. Suelen presentarse en forma de moléculas diatómicas de muy baja reactividad, es decir, que no reaccionan con otros elementos componiendo otras sustancias y, por este mismo motivo, son conocidos como gases inertes. Esto es debido a que en su última órbita hay el máximo número de electrones posibles para ese nivel, ocho en total.
Este selecto grupo de elementos está compuesto por helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe), radón (Rn) y oganesón (Og), anteriormente conocido como ununoctio.


Newsletter PyM
La pasión por la psicología también en tu email
Únete y recibe artículos y contenidos exclusivos
Suscribiéndote aceptas la política de privacidad