Todos hemos escuchado hablar alguna vez del ácido sulfúrico, aunque sea de pasada. Esta sustancia, extremadamente corrosiva y peligrosa, es el compuesto químico más producido en todo el mundo. Resulta particularmente importante en la industria del petróleo, el tratamiento de acero, la manufactura de explosivos, detergentes y plásticos y en la síntesis de fertilizantes.
Sin el ácido sulfúrico, tampoco sería posible poder impulsar la industria maderera y de papel, muchos procesos de las fábricas textiles o la producción de baterías. Tampoco se puede olvidar su papel en la industria química, ya que es necesario para la síntesis de otros ácidos y sulfatos vitales para ciertos procesos.
Dicho de otro modo, la sociedad no sería tal y como la conocemos sin el ácido sulfúrico, pues juega labores esenciales en la industria química, en la petrolera y en el campo agrícola, entre muchas otras cosas. De todas formas, no todos los compuestos del azufre son igual de conocidos. Aquí prestamos atención a uno mucho menos familiar para la población general: el ácido disulfúrico.
- Artículo relacionado: "Los 11 tipos de reacciones químicas"
¿Qué es el ácido disulfúrico?
El ácido disulfúrico, también conocido como ácido pirosulfúrico u óleum, es un oxácido del azufre. El término “oxácido” hace referencia a todo ácido que contenga oxígeno en su composición, especialmente aquellos que presentan en su estructura química al menos un átomo de hidrógeno (H), uno de oxígeno (O) y un elemento variable, sea este X.
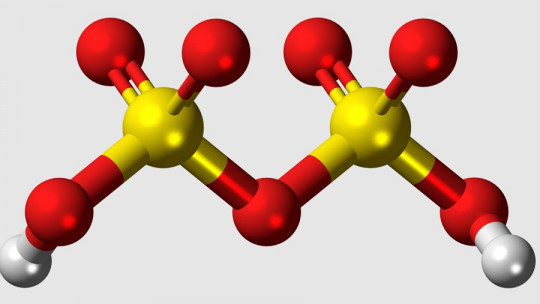
El ácido disulfúrico es el componente principal del ácido sulfúrico fumante u óleum, cuyas propiedades y usos explicaremos en futuros apartados. Por ahora, nos quedamos con que su estructura química es H2SO7. Esto quiere decir que está formado por dos átomos de hidrógeno (H2), 7 de oxígeno (O7) y dos de azufre (S2). El ácido sulfúrico al uso, por su parte, presenta dos átomos de hidrógeno, uno de azufre y cuatro de oxígeno (H2SO4).
También resulta de interés recalcar que este ácido tiene una masa molar de 178.13 g·mol−1 y que su punto de fusión es de 36 grados, temperatura que marca el cambio de un estado sólido a líquido. Existen otros ácidos con la misma fórmula “H2O·(SO3)x”, si bien estos no pueden aislarse en condiciones experimentales a día de hoy.
- Quizás te interese: "Las 15 propiedades físicas y químicas del agua"
Características del óleum
Como hemos dicho, el ácido disulfúrico es el componente principal del ácido sulfúrico fumante, también conocido como óleum. La fórmula de esta solución es ySO3·H2O, sendo “y” la masa molar total de la parte trióxido de azufre (SO3). De todas formas, también se puede designar con la nomenclatura “H2SO4·xSO3”, donde “x” hace referencia al contenido de trióxido de azufre libre molar. Cuando x=1 e y=2, se obtiene la fórmula H2S2O7, o lo que es lo mismo, la del ácido disulfúrico.
Puede sonar complejo, pero quédate con la siguiente idea: una solución de óleum puede tener distintas propiedades según el porcentaje de concentración de ácido sulfúrico y la conformación antes citada da lugar al ácido disulfúrico, que se presenta en forma sólida hasta los 36 grados de temperatura ambiental. Por interesante que suene a nivel químico todo este conglomerado, de todas formas, es necesario destacar que rara vez se utiliza el ácido disulfúrico en ambientes laboratoriales o en procesos industriales.
El óleum se sintetiza mediante un “proceso de contacto”, donde se le adicionan grupos oxígeno al azufre (S+O3, SO3) y luego se disuelve en un concentrado de ácido sulfúrico (H2SO4). Quizá un químico se tiraría de los pelos al ver una sobresimplificación tan grande, pero con fines divulgativos, nos tomamos la licencia para mostrarte la unión de ambos conceptos:

Así pues, el oleum o ácido disulfúrico típico se construye con azufre a la que se le ha adicionado oxígeno y concentrado de ácido sulfúrico. En el mundo de la química, al final todo es también cuestión de conocimiento matemático.
Funciones y utilidades de esta sustancia
Una vez hemos diseccionado la naturaleza química de esta solución tan compleja, podemos explorar sus usos, aunque sea de forma somera.
1. Producción de ácido sulfúrico
Aunque suene contraintuitivo, una solución que requiere de ácido sulfúrico para su síntesis puede ser útil para la producción del propio ácido sulfúrico.
Debido a su alta entalpía de hidratación (cambio en la entalpía cuando un mol de iones se disuelve en suficiente agua para dar una solución diluida), el oleum se puede diluir en agua para producir ácido sulfúrico concentrado adicional.
Por el contrario, si se adicionase SO3 directamente al agua, se formaría una película gaseosa de ácido sulfúrico muy difícil de manejar.
@image( 28510)
2. Intermediario de transporte
Como el oleum se presenta en estado sólido hasta los 36 grados de temperatura, puede ser útil para el transporte de ácido sulfúrico en camiones con tanques, entre refinerías de aceites y diversas industrias. Una vez llega a su destino, el oleum puede volver a transformarse en su estado líquido. De todas formas, este proceso debe llevarse a cabo de forma muy cuidadosa, pues un sobrecalentamiento del material (overheating) sobrepasa los límites de seguridad.
Además, el oleum o ácido disulfúrico es menos corrosivo que el ácido sulfúrico al uso al entrar en contacto con metales, pues no hay moléculas de agua libre que puedan atacar a estas superficies. Por ello, a veces también se opta por sintetizar ácido disulfúrico líquido para el transporte entre tuberías complejas. Debido a su capacidad para “revertirse” en ácido sulfúrico concentrado y su facilidad para cambiar de estado sólido a líquido, el oleum tiene muchas utilidades en el ámbito del transporte.
3. El ácido disulfúrico en la industria de los explosivos
El oleum también se utiliza en la síntesis de explosivos, con la notable excepción de la nitrocelulosa. Esto se debe a que las soluciones de ácido nítrico (NO3) y ácido sulfúrico (H2SO4, que podría obtenerse o no usando como base el ácido disulfúrico) contienen cantidades notables de agua, algo que las hace poco útiles en muchos procesos de manufacturación de explosivos.
4. Uso en el estudio de la química orgánica
El oleum es un agente reactivo agresivo y altamente corrosivo, útil como intermediario en ciertas reacciones químicas.
Resumen
En resumen, el ácido disulfúrico puede verse como un intermediario del ácido sulfúrico, a pesar de venir derivado de reacciones que lo requieren en primera instancia. Como se presenta en estado sólido de forma natural, es indicado para el transporte seguro en muchos sectores de la industria que manejan el H2SO4 de forma natural. También es muy interesante el uso de este compuesto en su forma líquida, pues al ser menos corrosivo que el ácido sulfúrico, genera menos daños en tuberías y otros revestimientos metálicos.
De nuevo, retomamos la idea de que el ácido sulfúrico es esencial en la industria agrícola, maderera, textil, petrolera y otras muchas ramas más. Así pues, aunque el ácido disulfúrico no sea de gran utilidad como compuesto directamente aplicable en el ámbito laboratorial, sí que otorga cierta plasticidad a la hora de transportar, refinar y tratar al propio ácido sulfúrico.


Newsletter PyM
La pasión por la psicología también en tu email
Únete y recibe artículos y contenidos exclusivos
Suscribiéndote aceptas la política de privacidad