Según el Estudio global de la carga de la enfermedad, el 95% de la población mundial tiene algún problema de salud, al menos en el grupo muestral analizado entre los años 1990 y 2013. No es de extrañar, pues el 15% de la biomasa mundial en forma de carbono está compuesta por bacterias (70 gigatoneladas), algunas de ellas beneficiosas para el ser humano, otras comensales y otras directamente patógenas.
Más allá de bacterias, existen miles de agentes infecciosos no-vivos en forma de virus, que mutan a una tasa frenética y evolucionan para sortear la inmunidad de los organismos a largo plazo. La competición del ser humano con los patógenos es una auténtica carrera armamentística: cuando se desarrolla una respuesta específica ante un patógeno, se espera que este termine mutando para dejar de ser reconocido por los linfocitos y otros cuerpos específicos.
Por esta razón, las campañas de vacunación de la gripe son anuales, mientras que otras vacunas otorgan inmunidad vitalicia ante un patógeno dado. Dependiendo de la tasa de mutación y adaptabilidad del microorganismo, las probabilidades de infección pueden aumentar o reducir con el tiempo. Con base en estas premisas tan interesantes, te contamos todo lo que debes saber sobre las inmunoglobulinas.
- Artículo relacionado: "Sistema inmunitario: qué es, partes, funciones y características"
¿Qué son las inmunoglobulinas?
Según el Instituto Nacional del Cáncer (NIH), una inmunoglobulina o anticuerpo es una proteína elaborada por las células plasmáticas (tipos de glóbulos blancos) en respuesta a la presencia de un antígeno, una sustancia que provoca que el sistema inmunitario del ser humano se active, al reconocerse como una amenaza. La clave de la comprensión de la inmunidad se basa en la díada anticuerpo (Ig) - antígeno (Ag) o lo que es lo mismo, Ig-Ag.
Cada inmunoglobulina se une a un solo antígeno, permitiendo que las células inmunes especializadas en destruir (como los macrófagos) reconozcan de forma más efectiva al patógeno y lo fagociten, pero algunas de ellas también pueden destruir al antígeno directamente. Cada anticuerpo posee un parátopo especializado o antigen binding site, el cual es específico del epítopo del propio antígeno. Dicho de otro modo, cada complejo Ig-Ag supone una llave y una cerradura intransferibles.
La utilidad más clara de las inmunoglobulinas en la sociedad general es, sin ninguna duda, el desarrollo de vacunas. Cuando se introduce un virus o bacteria debilitado en el organismo (o una sección del mismo que promueve una respuesta inmunitaria), se estimula la proliferación de linfocitos y la liberación de inmunoglobulinas específicas para dicho antígeno. Así, el cuerpo “aprende” cuál es el microorganismo peligroso, siempre desde la seguridad de una inactivación patogénica previa.
Gracias a este mecanismo seguro de inmunización, se estima que se han salvado más de 37 millones de vidas en todo el globo en los últimos 20 años, sobre todo en niños. Un ejemplo claro de ello es la viruela: en el siglo XVIII, 400.000 personas morían anualmente por esta enfermedad, lo que se transformaba en una tasa de letalidad del agente de casi un 30%. Gracias a la vacunación, el último caso de viruela se diagnosticó en 1977, y la OMS declaró el mundo libre del patógeno en los ochenta. Sin duda, el conocimiento de las inmunoglobulinas nos ha permitido librarnos como especie de estragos epidemiológicos.
Estructura de estas proteínas
Las inmunoglobulinas tienen una forma típica de “Y”, compuesta por dos mitades diferentes. Debes picturizar en tu mente esta conformación de forma clara antes de continuar, pues nos vamos a basar en este patrón para describir la conformación general de los anticuerpos.
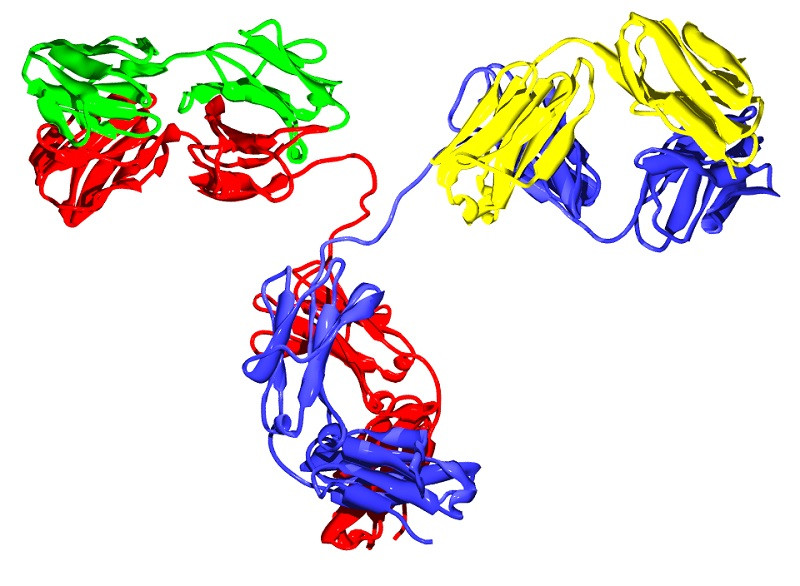
Como toda proteína, una inmunoglobulina tiene como unidad basal al aminoácido, cada una de las subunidades que, unida mediante enlaces peptídicos, da lugar a péptidos (menos de 10 aminoácidos), polipéptidos (más de 10) y proteínas (muchos aminoácidos concatenados). En este caso, la inmunoglobulina tipo está compuesta por 4 unidades polipeptídicas: dos cadenas pesadas iguales entre ellas (Heavy, en la base y escisión de la “Y”) y 2 cadenas ligeras idénticas entre sí (Light, cada una de las puntas laterales de las ramificaciones de la “Y”).
Cada región “H” está compuesta por una región variable (VH) y 3-4 regiones constantes (CH1, CH2,CH3, etc.). Por otro lado, las cadenas ligeras “L” se componen de una región variable (VL) y otra constante (CL). Todo esto puede sonar muy lioso, pero solo hace falta quedarse con el siguiente concepto: las puntas de las cadenas pesadas (H) y ligeras (L) son variables, mientras que la conformación en general de “Y” es constante entre inmunoglobulinas del mismo tipo.
La forma en “Y” es la típica que se expone en clases de biología e inmunología, pero no la única. Esta forma monomérica engloba a las inmunoglobulinas D, E y G, mientras que la Ig A es un dímero y la Ig M es un pentámero. Como podrás imaginar, estos cambios anatómicos también suponen una clara variabilidad en la funcionalidad.
- Quizás te interese: "Los 4 tipos de agentes patógenos (y sus características)"
Los tipos de inmunoglobulinas
Salimos del bosque molecular para volver a temáticas un poco más generales, esta vez, las distintas funciones de las inmunoglobulinas según su designación. Te las describimos de forma somera.
1. Inmunoglobulina A
Se encuentra en los revestimientos mucosos de las vías respiratorias, el tracto urogenital y la luz del sistema digestivo, además de la saliva, las lágrimas y la leche materna. Curiosamente, en sangre se encuentra en una forma monomérica (como la “Y” descrita), pero en las mucosas su disposición es dimérica.
Debido a su cercanía con los únicos sistemas abiertos dentro del cuerpo humano (excretor, respiratorio y digestivo), estas inmunoglobulinas son las primeras en entrar en contacto con virus que invaden la cavidad orofaríngea y otros microorganismos intestinales.
2. Inmunoglobulina G
Esta inmunoglobulina es la que más representada está en la sangre, el líquido cefalorraquídeo y el líquido peritoneal (de la cavidad abdominal). Constituye el 80% de las inmunoglobulinas totales, así que sin ninguna duda es la predominante.
Además, cabe destacar que existen 4 subvariantes de este tipo de inmunoglobulina, de la IgG 1 a la IgG4. Cada una de ellas son especialmente hábiles en un frente concreto, detectando antígenos y toxinas de distintos microorganismos.
3. Inmunoglobulina M
Se expresa en la superficie de los linfocitos B, los principales efectores de la respuesta humoral del sistema inmunitario adaptativo.
Son la respuesta de contingencia ante una infección, pues eliminan a los patógenos en estadios tempranos hasta que el sistema inmune sintetiza suficientes IgG-tipo s. Suponen el 6% de las inmunoglobulinas circulantes en el torrente sanguíneo humano y se encuentran presentes en la gran mayoría de animales, de ahí que se consideren los anticuerpos más antiguos de la historia evolutiva en vertebrados.
4. Inmunoglobulina E
El anticuerpo que se relaciona a nivel clínico con los cuadros alérgicos. Normalmente, esta inmunoglobulina se encuentra en pequeñas cantidades circulante en sangre, pero aumenta de forma drástica cuando se expone al organismo a un alérgeno, o lo que es lo mismo, una sustancia inocua que provoca una reacción no justificada en el sistema inmunitario del individuo. También se expresa en cantidades atípicas ante infecciones parasíticas.
5. Inmunoglobulina D
Esta es una de las inmunoglobulinas que menos se expresa, pero no por ello es menos importante. Solo representa el 1% de las inmunoglobulinas totales del organismo y es el mayor componente de la superficie de muchos linfocitos tipo B en su etapa de maduración. Debido a su escasez, su función está menos definida que la del resto de variantes ya descritas.
Resumen
Como habrás podido comprobar, las inmunoglobulinas vienen en diversas formas (isotipos) y disposiciones morfológicas, pero todas ellas tienen una función muy clara: proteger al organismo de posibles infecciones y patógenos. Desde virus a parásitos morfológicamente más complejos (como helmintos), las inmunoglobulinas son capaces de reconocerlos, activar al resto de células inmunes, marcarlos con base en sus antígenos de superficie y, tras la reacción en cascada pertinente, eliminarlos.
En resumen, las inmunoglobulinas son proteínas secretadas por los linfocitos B y células plasmáticas, en respuesta a un antígeno que se ha infiltrado en el organismo del hospedador. Desde respuestas inmunitarias a reacciones alérgicas, los anticuerpos tienen diversas funciones protectoras.


Newsletter PyM
La pasión por la psicología también en tu email
Únete y recibe artículos y contenidos exclusivos
Suscribiéndote aceptas la política de privacidad










-default-small.jpg)





