El mundo de la bioquímica humana, en todas sus acepciones, explica los procesos metabólicos que ocurren en nuestro interior. Más allá de conceptos etéreos e identidades propias, debemos reconocer que el ser humano no es más que un conjunto de rutas químicas, impulsos eléctricos, respiraciones celulares y cadenas polipeptídicas, al menos a un nivel meramente fisiológico.
Por ello, miles de pequeñas moléculas explican nuestros comportamientos, hábitos y dolencias. Las enzimas gástricas se encargan de la digestión en el estómago, la hemoglobina de los glóbulos rojos permite la transmisión de oxígeno a nuestros tejidos y la liberación de complejos sinápticos entre neuronas nos capacitan para pensar, ni más ni menos. Dicho de forma sencilla: somos las biomoléculas que sintetizamos, por pequeñas o nimias que estas parezcan.
Entre todo el conglomerado biológico que es el cuerpo humano, existen una serie de proteínas o conjugados encargados de funciones muy concretas, que suelen escapar de la atención general por el lenguaje específico que conllevan. Aquí veremos qué es la mioglobina, una heteroproteína muscular que presenta muchas similitudes con la hemoglobina clásica.
- Artículo relacionado: "Sistema circulatorio: qué es, partes y características"
¿Qué es la mioglobina?
La mioglobina es una heteroproteína, es decir, que está compuesta por una parte proteica (apoproteína, aminoácidos unidos mediante enlaces peptídicos) y otra no proteica de menor tamaño, el grupo prostético. La característica diferencial clave entre una proteína al uso (holoproteína) y una heteroproteína es que esta última presenta en su estructura tridimensional lípidos, glúcidos, ácidos nucléicos e incluso metales.
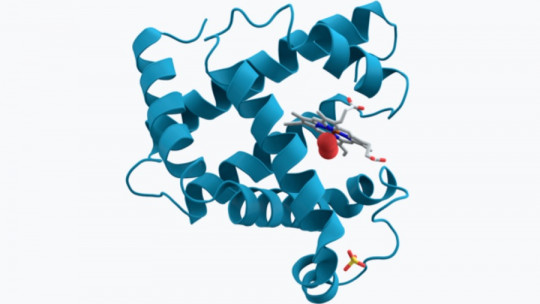
Afinando más el hilo, podemos destacar que la mioglobina es una heteroproteína de tipo cromoproteico, ya que presenta un metal en su composición química, lo que le otorga una tinción característica. La mioglobina está compuesta por una sección polipeptídica de 153 aminoácidos y por un grupo hemo que contiene un átomo de hierro, al igual que la hemoglobina. Debido a este grupo “hemo”, podemos afirmar que la función principal de la mioglobina es almacenar oxígeno.
Además, cabe destacar que la mioglobina está compuesta por una sola cadena polipeptídica formada por 8 hélices alfa (estructura secundaria de la conformación de aminoácidos), que se asocia con un punto de inserción de oxígeno. En el centro, presenta un anillo de porfirina que contiene hierro. Un grupo de histidina proximal (His-93) se asocia directamente a la molécula de hierro, mientras que un grupo de histidina distal (His-64) se coloca en la cara contraria de la formación.
En contraposición, la hemoglobina (encargada de transportar el oxígeno en sangre, dentro de los glóbulos rojos) está compuesta por cuatro polipéptidos diferentes y cuatro puntos de unión del oxígeno, lo que permite diversas propiedades cinéticas de unión. Se podría decir que, desde un punto de vista químico, esta es más “compleja” que la mioglobina.
Si queremos que te quedes con una idea de todo este conglomerado, es la siguiente: la mioglobina está formada solo por una cadena de aminoácidos (polipéptido), que a su vez se presenta en forma de 8 hélices alfa conectadas, dispuestas de forma enrollada sobre la conformación tridimensional. En el centro de la heteroproteína hay un grupo hemo, con una molécula de hierro. Si pudiésemos desenrollar su estructura terciaria, veríamos un cordel de 8 subunidades unido a un anillo hemo.
- Quizás te interese: "Eritrocitos (glóbulos rojos): características y funcionamiento"
Función de la mioglobina
Al igual que la hemoglobina, la mioglobina es una heteroproteína citoplasmática que posibilita la unión del oxígeno a un grupo hemo. De todas formas, al poseer cuatro cadenas polipeptídicas (globina), la hemoglobina tiene cuatro grupos hemo, lo que le permite adherir más oxígeno a su estructura terciaria. Así pues, la hemoglobina presenta más “carga de oxígeno”, mientras que la mioglobina tiene una mayor afinidad al mismo, pero en menor cantidad (solo un grupo hemo/una molécula de O2). Estas diferencias van en conjunción con la funcionalidad de cada molécula: la hemoglobina transporta, mientras que la mioglobina almacena.
En este punto, cabe destacar que las concentraciones de mioglobina son máximas en la musculatura estriada de los vertebrados, en específico, en el citoplasma de los cardiomiocitos y en el sarcoplasma de las fibras musculares. Con base en esta premisa, se puede asumir que la función principal de la mioglobina es aportar oxígeno a las mitocondrias musculares cuando el organismo está en un momento de esfuerzo, con el fin de evitar la hipoxia a nivel tisular.
Dicho de otro modo, la mioglobina sirve de buffer de la concentraciòn intracelular de oxígeno y también como una reserva de O2 a nivel muscular. Este concepto se confirma por una realidad tan curiosa como esperada: los animales que viven en el agua y pasan grandes periodos de tiempo sumergido presentan 30 veces más mioglobina en su entorno celular, en comparación con aquellos que tienen oxígeno disponible en todo momento.
Estas son algunas funciones más de la mioglobina, contextualizadas en el entorno del organismo:
- Facilita la difusión de oxígeno: esta heteroproteína se desatura al inicio de la actividad muscular, lo que aumenta el gradiente de difusión de oxígeno desde los capilares hasta el citoplasma.
- Parece tener funciones enzimáticas: se necesita para la descomposición activa de óxido nítrico a nitrato. El metabolismo del óxido nítrico favorece la actividad mitocondrial.
- Ayuda a eliminar especies reactivas de oxígeno (ROS): las ROS son moléculas muy pequeñas derivadas del metabolismo celular de forma normal, pero estas pueden dañar a la célula y provocar su envejecimiento. Por ello, la mioglobina ayuda a que sus concentraciones sean mínimas.
Como puedes ver, la funcionalidad de la mioglobina no solo radica en el almacenaje de una molécula de O2 gracias a su grupo hemo. Aunque esta sea su labor principal, también presenta otras, igual de importantes para el bienestar en el entorno celular.
El papel de la mioglobina en los cuadros clínicos
La mioglobina se encuentra codificada por el gen MB en humanos, y como toda secuencia ordenada de ADN, esta es susceptible a mutaciones. Se ha asociado la disfuncionalidad del gen MB con diversas condiciones, como el síndrome compartimental o el meduloblastoma.
Además, modelos experimentales (ratones knockout) con la mioglobina mutada desarrollan enfermedades letales a nivel cardíaco durante el desarrollo fetal. Los pocos modelos que sobreviven a estas condiciones expresan mecanismos compensatorios, pero la supervivencia es baja. Por ello, se afirma que la mioglobina es esencial para el funcionamiento del cuerpo.
Más allá de terrenos conjeturales, se ha asociado de forma directa a la mioglobina con una entidad clínica ampliamente conocida: la rabdomiolisis. En esta condición grave, se produce un daño en la membrana del miocito (célula muscular), que deriva en la acumulación de calcio de forma anormal dentro del músculo. Esto supone lisis y necrosis muscular, lo que a su vez aumenta la concentración en sangre de moléculas que no deberían estar allí.
Curiosamente, la mioglobina es la proteína que más daños genera en los riñones cuando se infiltra en el aparato circulatorio y termina siendo “filtrada” en el entorno renal. Se cree que esta heteroproteína puede precipitar en los túbulos del riñón, acumulándose y causando obstrucciones. Este mecanismo de toxicidad explica, en parte, por qué el fallo renal es uno de los principales efectos secundarios de la rabdomiolisis.
Por último, cabe destacar que se mide la presencia de mioglobina en la orina para detectar esta condición, ya que una concentración de 100 mg/dl es capaz de cambiar el color del pis.
Resumen
Cuando prestamos atención en una proteína, enzima o molécula relacionada con el metabolismo, quedarse solo con su estructura y función principal es un grave error. Sí, la mioglobina almacena oxígeno para evitar la hipoxia muscular, pero también tiene actividad enzimática, neutraliza especies reactivas de oxígeno, facilita la difusión de O2 en el entorno celular y sirve como uno de los criterios diagnósticos para la rabdomiolisis (ya sea en su concentración plasmática o en orina).
Al fin y al cabo, toda biomolécula tiene más de una función en nuestro cuerpo, y si creemos que solo cumple una labor, seguramente será porque no hemos descubierto el resto.


Newsletter PyM
La pasión por la psicología también en tu email
Únete y recibe artículos y contenidos exclusivos
Suscribiéndote aceptas la política de privacidad