El ser humano y el resto de animales somos sistemas abiertos, ya que requerimos la ingesta de materia orgánica para obtener energía. El 50% de nuestra dieta está compuesta por hidratos de carbono, el 30% por grasas y el 10-15% por proteínas.
Todos estos macronutrientes se descomponen mediante hidrólisis en biomoléculas pequeñas, que atraviesan la membrana plasmática de las células y se oxidan en el entorno mitocondrial, con el fin de obtener energía para todos los tejidos y reacciones necesarias para la vida.
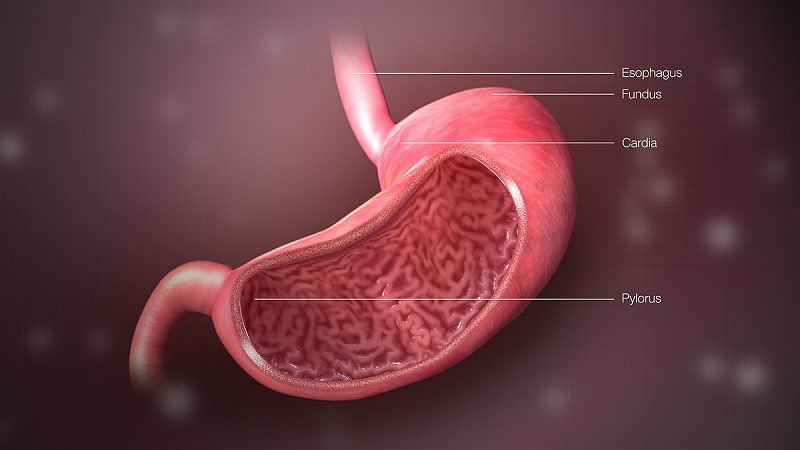
La digestión, conocida como el proceso por el cual un alimento es transformado en el aparato digestivo en una sustancia que el organismo asimila, es esencial para que la comida termine convertida en energía y calor metabólico. Para ello, el alimento es ingerido por la boca, sometido a una serie de cambios mecánicos y químicos, transportado al estómago, luego a los intestinos y, por último, se eyectan los desechos al medio en forma de heces.
Este proceso general describe el paso de alimento por el aparato digestivo de forma extremadamente somera, pero cabe destacar que cada una de estas secciones del sistema se caracteriza por una serie de reacciones químicas y físicas de gran interés. Hoy te lo contamos todo sobre la pepsina, una de esas enzimas esenciales para comprender la digestión a nivel gástrico.
- Artículo relacionado: "Sistema digestivo: anatomía, partes y funcionamiento"
¿Qué es la pepsina?
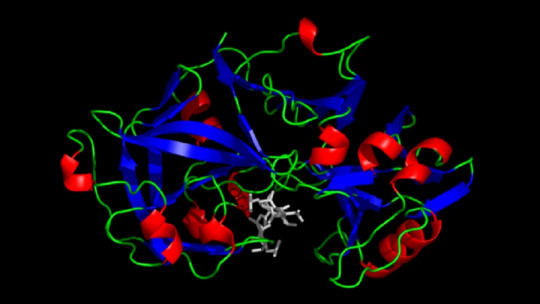
En primer lugar, es necesario destacar que la pepsina es una endopeptidasa, es decir, una enzima que disgrega las proteínas obtenidas en la ingesta dietética en péptidos más pequeños. Este tipo de moléculas enzimáticas rompen los enlaces peptídicos entre aminoácidos dentro de la cadena proteica, siguiendo una serie de guías muy concretas. La pepsina no es la única endopeptidasa encargada de la digestión, pues en este grupo también destacan la tripsina, quimiotripsina, elastasa o termolisina, entre otras.
A pesar de la variedad de endopeptidasas en el entorno gástrico, la pepsina se considera una de las más importantes, junto con la tripsina y quimiotripsina. Además, su entorno de acción es muy claro y delimitado: funciona en su mayor efectividad entre un pH de 1,5 y 2, las condiciones exactas ideales del estómago. Una vez llega a la porción del duodeno (con un pH 6), esta enzima se inactiva y su funcionalidad llega a su fin (aunque mantiene su conformación tridimensional hasta un pH de 8).
De todas formas, es necesario aclarar que la digestión proteica también continúa a nivel intestinal, debido a los efectos de enzimas pancreáticas como la tripsina, quimiotripsina, elastasa y carboxipeptidasa. Así pues, a pesar de su esencialidad, la pepsina no es indispensable para la vida: si esta enzima falta, otras se pueden encargar del metabolismo proteico, con más o menos esfuerzo.
Curiosamente, la actividad enzimática de la pepsina y otras enzimas podría llegar a autodegradar el propio tejido del organismo si no existieran mecanismos preventivos claros y efectivos. Por suerte, la barrera mucosa del estómago secreta una sustancia de tipo moco-bicarbonato, que le otorga a la pared gástrica casi un entorno de pH neutro y desactiva a la pepsina. El propio estómago debe protegerse de la actividad enzimática que tiene lugar en su interior, por contraintuitivo que suene.
La síntesis de la pepsina
La pepsina se sintetiza en el estómago, tal y como hemos dejado entrever en líneas anteriores. De todas formas, las células estomacales (células principales de las glándulas gástricas) no secretan pepsina en sí misma, sino pepsinógeno. Este compuesto es un zimógeno o proenzima inactiva, que contiene 44 aminoácidos “extras”, en comparación con la enzima real.
La hormona gastrina, segregada por las células G del aparato gástrico, estimula la secreción de pepsinógeno y ácido clorhídrico, el cual genera un entorno de pH muy ácido dentro de la cámara estomacal. Cuando el pepsinógeno entra en contacto con este conglomerado ácido, sufre una reacción autocatalítica, en la que se libera de la “cola” de aminoácidos que lo mantenían inactivo. Así pues, gracias a la presencia de ácidos estomacales, el pepsinógeno se transforma en su variante activa pepsina y esta puede comenzar a disgregar las proteínas en moléculas más pequeñas.
Además, es necesario apuntar que el pepsinógeno se sintetiza gracias a las instrucciones presentes en los genes, es decir, los cromosomas dentro de las células. En el ser humano, existen 3 genes diferentes que codifican para la misma forma del pepsinógeno A: PGA3, PGA4 y PGA5. Todos ellos tienen las direcciones de la síntesis del zimógeno, que luego se transforma en la enzima por la estimulación de los ácidos gástricos.
Por otro lado, algunos compuestos (como la pepstatina) son capaces de inhibir la pepsina a concentraciones muy bajas. La pepstatina fue aislada por primera vez en cultivos de hongos actinomicetos, pero poco más se conoce de ella más allá de su actividad como proteasa.
- Quizás te interese: "Tabla de aminoácidos: funciones, tipos y características"
Función de la pepsina
En este punto, es esencial destacar que la pepsina se dedica a romper las proteínas, pero al estar compuesta por aminoácidos, esta enzima también es una proteína en sí misma. Los aminoácidos son la unidad básica de toda proteína, pues estos se unen en órdenes específicos mediante enlaces peptídicos para dar lugar a péptidos (menos de 10 aminoácidos), polipéptidos (de 10 a 50 aminoácidos) y proteínas (más de 50 aminoácidos).
Por su parte, la pepsina “corta” la cadena proteica que se quiere degradar al nivel de los aminoácidos leucina (leu) fenilalanina (phe), triptófano (trp) o tirosina (tyr), a menos que alguno de ellos vaya precedido de prolina (pro). Recordamos que se trata de una endopeptidasa, lo que quiere decir que corta “por dentro” (entre aminoácidos que no forman parte de la sección proteica terminal).
Las proteínas solo suponen un 10-15% de nuestra dieta (ya que los carbohidratos son la fuente más rica de energía), pero estas suponen el 50% del peso seco de casi todos los tejidos biológicos, pues no existe proceso metabólico que no dependa en cierto modo de ellas. Por ello, la pepsina y el resto de enzimas que degradan las proteínas son tan esenciales: no solo para la obtención de energía, sino para la integración de los aminoácidos en tejidos biológicos, como los músculos y la piel.
El papel de la pepsina en las patologías
Como todo elemento del cuerpo humano, la pepsina puede llegar a fallar o realizar actividades en momentos en los que no es necesaria, lo cual desemboca en patologías. En este caso, esta y otras enzimas juegan un papel esencial en el desarrollo de síntomas del reflujo laringofaríngeo (LPR) y reflujo gastroesofágico (GERD).
Una persona con un esfínter esofágico inferior (LES) debilitado puede llegar a experimentar estas condiciones, ya que el bolo alimenticio mezclado con los jugos gástricos retrocede hacia el esófago si no se delimita bien el entorno del estómago. Esto provoca que los ácidos, la pepsina y otras enzimas recorran el tubo esofágico hacia atrás, llegando incluso a la laringe y, en los peores casos, al entorno pulmonar.
Para complicar aún más las cosas, los pacientes con LPR tienen una sensibilidad neural local alterada, así que no pueden responder con toses y estertores a la presencia de ácido en el entorno laríngeo. Al encontrarse en su forma activa y no ser excretada, la pepsina empieza a degradar los tejidos laríngeos, lo que se traduce en disfagia crónica (imposibilidad para tragar), voz áspera y toses repetidas. Cuanto más esté la pepsina en contacto con el entorno laríngeo, peores serán los daños.
Resumen
Como habrás podido comprobar, la pepsina es una enzima de lo más interesante a nivel fisiológico, ya que se autoactiva a sí misma con el entorno acídico del estómago y su funcionalidad se regula de forma completamente dependiente al pH ambiental. Si el pH se mantiene entre 1,5 y 2, la enzima permanece en su forma activa y realiza su trabajo. Cuando este valor cambia, mantiene su conformación tridimensional, pero no disgrega las proteínas como dentro del estómago.
Gracias a la pepsina y otras muchas biomoléculas de naturaleza enzimática, los seres humanos podemos transformar las proteínas que consumimos en energía y, sobre todo, en aminoácidos útiles para la formación y reparación de tejidos. Desde luego, nos queda claro que sin nuestro metabolismo interno no somos nada.


Newsletter PyM
La pasión por la psicología también en tu email
Únete y recibe artículos y contenidos exclusivos
Suscribiéndote aceptas la política de privacidad